فلزات، ستون فقرات تمدن صنعتی بشرند؛ از پلها و ساختمانها گرفته تا هواپیماها، خودروها و خطوط لولهای که انرژی را در سراسر جهان جابهجا میکنند. اما در پسِ درخشش و استحکام این مواد شگفتانگیز، دشمنی خاموش و دائمی در کمین است: خوردگی فلزات. فرایندی آرام اما بیرحم که میتواند سازهای عظیم را از درون تهی کند، تأسیساتی میلیاردی را از کار بیندازد و حتی جان انسانها را به خطر اندازد.
خوردگی تنها یک واکنش شیمیایی ساده نیست؛ بلکه جنگی ناپیدا میان طبیعت و فناوری است. طبیعت میخواهد فلز را به همان حالت اولیه و پایدارش برگرداند؛ همانگونه که در دل زمین به شکل اکسیدها و ترکیبات معدنی وجود داشته است. از سوی دیگر، انسان تلاش میکند این روند را متوقف کند، چون دوام سازهها، امنیت صنایع و حتی اقتصاد جهانی به مقاومت فلزات در برابر این پدیده بستگی دارد.
شاید تصور کنیم زنگزدگی تنها یک لکهی قرمز روی آهن است، اما واقعیت این است که سالانه میلیاردها دلار در سراسر دنیا صرف مبارزه با خوردگی میشود. درک مکانیزمها، انواع و روشهای پیشگیری از خوردگی، نهتنها اهمیت علمی دارد، بلکه برای حفظ ایمنی، بهینهسازی هزینهها و پایداری زیرساختها ضروری است.
در این مقاله، با نگاهی دقیق و کاربردی، به ماهیت خوردگی فلزات، انواع آن، عوامل مؤثر و روشهای کنترل و پیشگیری خواهیم پرداخت؛ سفری از سطح براق فلز تا عمیقترین واکنشهای شیمیایی درون آن.
خوردگی فلزات چیست و چگونه اتفاق میافتد؟
خوردگی بهطور ساده به فرایندی گفته میشود که طی آن فلز در اثر واکنش با محیط اطراف خود (مانند هوا، رطوبت، اسیدها یا نمکها) دچار تجزیه شیمیایی یا الکتروشیمیایی میشود و خواص مکانیکی، ظاهری یا ساختاری آن کاهش پیدا میکند.
به عبارت دیگر، این فرایند نوعی بازگشت فلز به حالت طبیعی خود در پوسته زمین است؛ یعنی فلزات که در طبیعت بهصورت ترکیبهای پایدار مثل اکسیدها یا سولفیدها وجود دارند، دوباره تمایل دارند به همان حالت برگردند.

مکانیزم کلی خوردگی فلزات
در اغلب موارد، خوردگی از طریق واکنش الکتروشیمیایی اتفاق میافتد. این واکنش معمولاً شامل دو بخش است:
ناحیه آندی: در این بخش از سطح فلز، اتمهای فلز الکترون از دست میدهند و به صورت یون در محلول وارد میشوند.
مثال:
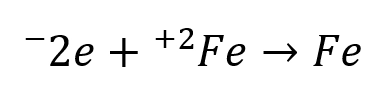
ناحیه کاتدی: الکترونهایی که در مرحله قبل آزاد شدهاند، در بخش دیگری از سطح فلز با مادهای از محیط (مثل اکسیژن یا یونهای هیدروژن) ترکیب میشوند. مثال:
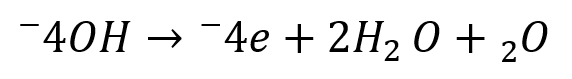
ترکیب این دو واکنش باعث میشود فلز بهتدریج حل شود، زنگ بزند یا لایههایی از ترکیبات ثانویه روی سطح آن تشکیل شود (مثل زنگ آهن).
شرایط لازم برای وقوع خوردگی فلزات
برای اینکه خوردگی فلز اتفاق بیفتد، وجود چند عامل ضروری است:
- فلز فعال: سطحی که بتواند الکترون از دست بدهد (مثلاً آهن یا آلومینیوم).
- محیط الکترولیتی: وجود رطوبت، محلول نمکی یا اسید که بتواند جریان یونها را برقرار کند.
- اکسیژن یا پذیرنده الکترون: تا واکنش کاتدی کامل شود.
- اختلاف پتانسیل الکتریکی در سطح فلز: که باعث جریان الکترون و شروع واکنشها شود.
اگر هر کدام از این عوامل حذف شود (مثلاً رطوبت یا اکسیژن قطع شود)، خوردگی تا حد زیادی متوقف میگردد.
مثال ساده: زنگ زدن آهن
وقتی آهن در معرض هوا و رطوبت قرار میگیرد، اکسیژن هوا در حضور آب با آهن واکنش میدهد و ترکیباتی مثل Fe(OH)₃ یا Fe₂O₃·nH₂O (زنگ آهن) را تشکیل میدهد. این لایه متخلخل است و از فلز زیرین محافظت نمیکند، به همین دلیل خوردگی ادامه پیدا میکند تا تمام فلز از بین برود.
چرا خوردگی فلزات مهم است؟
خوردگی فقط یک تغییر ظاهری نیست؛ بلکه میتواند باعث:
- کاهش استحکام و شکست قطعات فلزی
- از کار افتادن تجهیزات صنعتی
- آلودگی محصولات (مثلاً در صنایع غذایی یا دارویی)
- خسارات مالی سنگین و حتی خطرات ایمنی شود.
بهعنوان نمونه، طبق آمار جهانی، سالانه بیش از 3 تا 4 درصد تولید ناخالص داخلی کشورها صرف جبران خسارتهای ناشی از خوردگی میشود.
انواع خوردگی فلزات و روشهای شناسایی آن
خوردگی فلز تنها به زنگزدگی یا تغییر رنگ محدود نمیشود؛ در واقع، خوردگی میتواند اشکال گوناگونی داشته باشد و هر نوع آن بسته به شرایط محیطی، ترکیب شیمیایی فلز و نوع تنش واردشده، مکانیزم خاصی دارد. در ادامه، مهمترین انواع خوردگی فلزات و روشهای شناسایی هر یک بررسی میشود.
خوردگی یکنواخت
در این نوع، سطح فلز بهطور یکنواخت و همگن دچار اکسیداسیون میشود. سرعت خوردگی در تمام نقاط تقریباً برابر است و فلز بهتدریج نازک میشود. نمونه بارز این نوع خوردگی، زنگزدگی ورقهای فولادی در هوای مرطوب یا خوردگی آلومینیوم در محیطهای اسیدی ملایم است.
این نوع خوردگی معمولاً قابل پیشبینی است و در صنایع سهم زیادی دارد. کنترل آن از طریق رنگ، پوششهای محافظ یا آندهای فداشونده امکانپذیر است. برای شناسایی این نوع خوردگی از اندازهگیری کاهش ضخامت با کولیس یا میکرومتر، روش وزن از دسترفته و محاسبه نرخ خوردگی استفاده میشود.
خوردگی موضعی یا حفرهای
خوردگی موضعی زمانی رخ میدهد که واکنش خوردگی فقط در نقاط محدودی از سطح فلز اتفاق افتاده و حفرههایی عمیق ایجاد کند. این نوع خوردگی بسیار خطرناک است زیرا ممکن است سطح ظاهری سالم به نظر برسد ولی در عمق فلز آسیب جدی ایجاد شود.
یکی از نمونههای متداول آن، ایجاد سوراخ در لولههای فولادی ضدزنگ در محیطهای حاوی کلرید است. خوردگی حفرهای معمولاً با حضور یونهای کلرید آغاز میشود و بهسختی قابل کنترل است. برای شناسایی این نوع از خوردگی فلزات از میکروسکوپ نوری یا الکترونی (SEM) و اندازهگیری عمق حفرات استفاده میشود.
خوردگی شیاری
وقتی فلز در نواحی بسته مانند زیر واشر، پیچ یا محل تماس دو قطعه قرار بگیرد، مقدار اکسیژن در آن قسمت کمتر میشود و خوردگی موضعی در داخل شکاف شکل میگیرد.
نمونه بارز آن خوردگی فلزات در اتصالات پیچ و مهره فولاد ضدزنگ یا بین ورقهای همپوشان است. این نوع خوردگی به دلیل اختلاف غلظت اکسیژن میان داخل و خارج شکاف رخ میدهد و معمولاً در نقاط غیرقابل دید اتفاق میافتد. شناسایی آن با جداسازی قطعات، استفاده از روشهای غیرمخرب مانند التراسونیک (UT) و رادیوگرافی (RT) انجام میشود.
خوردگی گالوانیکی
زمانی که دو فلز مختلف در تماس الکتریکی با هم و در حضور الکترولیت قرار گیرند، فلز فعالتر دچار خوردگی سریعتر میشود، در حالی که فلز نجیبتر محافظت میشود. برای مثال، وقتی فولاد و مس در آب دریا به هم متصل باشند، فولاد بهعنوان آند سریعتر خورده میشود.
شدت خوردگی به اختلاف پتانسیل بین دو فلز و نسبت سطح آند به کاتد بستگی دارد. این نوع خوردگی با عایقکاری، استفاده از فلزات همپتانسیل یا آندهای فداشونده قابل کنترل است. برای شناسایی آن از بررسی بصری نواحی تماس دو فلز و اندازهگیری پتانسیل الکتریکی بین آنها استفاده میشود.

خوردگی بیندانهای
در این نوع خوردگی فلزات، حمله خوردگی در مرز دانههای کریستالی فلز اتفاق میافتد در حالی که خود دانهها تقریباً سالم میمانند. علت اصلی آن معمولاً رسوب ترکیباتی مانند کاربید کروم در مرز دانهها در اثر حرارتدهی یا جوشکاری نادرست است. نمونه مشخص آن در فولادهای زنگنزن است که در محدوده دمایی 450 تا 850 درجه سانتیگراد حساس میشوند.
فلز در ظاهر سالم به نظر میرسد اما از درون تضعیف شده و ممکن است ناگهان بشکند. شناسایی این نوع خوردگی با متالوگرافی، آزمونهای استاندارد مانند Strauss و Huey Test و بررسی ساختار میکروسکوپی انجام میشود.
خوردگی تنشی
در این حالت، وجود تنشهای مکانیکی (داخلی یا خارجی) همراه با محیط خورنده باعث ایجاد ترکهای ریز در فلز میشود که به مرور رشد کرده و منجر به شکست ناگهانی میگردد.
این نوع خوردگی معمولاً در محیطهای حاوی کلرید یا آمونیاک رخ میدهد و آلیاژهایی مانند فولادهای ضدزنگ، برنج و آلومینیوم نسبت به آن حساساند. برای شناسایی این پدیده از روشهای غیرمخرب مانند التراسونیک، آکوستیک امیشن و مشاهدات میکروسکوپی سطح شکست استفاده میشود.
خوردگی سایشی
خوردگی سایشی زمانی اتفاق میافتد که واکنش شیمیایی خوردگی با سایش مکانیکی ترکیب شود. جریان سریع سیالات لایه محافظ اکسید را از بین میبرد و فلز بهطور مداوم در معرض خوردگی قرار میگیرد.
این نوع خوردگی فلزات در زانوهای لولهها، پمپها و پروانههای توربین آبی بسیار شایع است. در سطح فلز معمولاً الگوهای موجی یا حفرهای دیده میشود. برای شناسایی آن از مشاهده چشمی، اندازهگیری میزان کاهش جرم و تحلیل جریان سیال استفاده میشود.
خوردگی میکروبی
در برخی محیطها، باکتریها و میکروارگانیسمها با تولید موادی مانند سولفید هیدروژن (H₂S) یا اسیدهای آلی موجب تسریع خوردگی میشوند. این نوع خوردگی اغلب در مخازن نفت خام، لولههای زیرزمینی و سیستمهای خنککننده صنعتی مشاهده میشود.
ظاهر سطح معمولاً لکهای و با رنگهای سیاه یا سبز تیره است. برای شناسایی آن از نمونهبرداری میکروبی، آزمونهای میکروسکوپی و تحلیل ترکیب محصولات خوردگی استفاده میشود.
نتیجهگیری
خوردگی فلزات پدیدهای طبیعی اما زیانبار است که با واکنشهای شیمیایی و الکتروشیمیایی، استحکام و کارایی فلزات را کاهش میدهد. این فرایند میتواند از زنگزدگی ساده تا انواع خطرناکتر مانند خوردگی تنشی یا میکروبی گسترش یابد و خسارات مالی و ایمنی سنگینی به صنایع وارد کند.
شناخت انواع خوردگی و درک شرایط مؤثر بر آن، پایهی اصلی طراحی راهکارهای پیشگیری است. استفاده از پوششهای محافظ، انتخاب آلیاژ مناسب، کنترل رطوبت و پایش منظم تجهیزات، آبکاری برای جلوگیری از خوردگی از مؤثرترین روشهای مقابله با این پدیدهاند.
در نهایت، کنترل خوردگی فلز تنها یک اقدام فنی نیست، بلکه تلاشی برای حفظ سرمایهها، افزایش ایمنی و تداوم توسعه صنعتی محسوب میشود.


